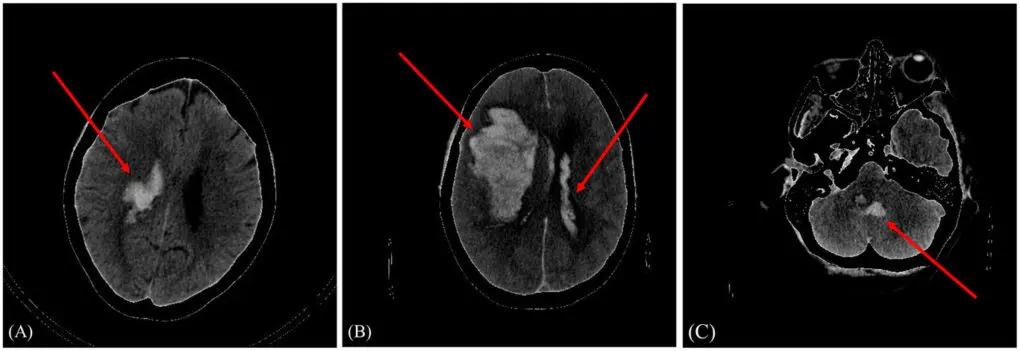
Investigadores del IFCA participan en la creación de un modelo que predice el pronóstico de un paciente tras una hemorragia intracraneal
Un modelo que es capaz de predecir el pronóstico, favorable o no, de un paciente tras sufrir una hemorragia intracraneal. Es uno de los resultados de la tesis doctoral de Amaia Pérez del Barrio, médico radióloga del Hospital Universitario de Navarra, durante su residencia en el Hospital Universitario Marqués de Valdecilla (HUMV), y codirigida por Lara Lloret, investigadora del Grupo de Computación Avanzada del Instituto de Física de Cantabria (IFCA, CSIC-UC) y el doctor de la Universidad de Oviedo, José Antonio Vega.
El estudio, que se ha publicado en la revista JournalofNeuroimaging, cuenta con la participación de David Rodríguez, investigador del IFCA, y un equipo de radiólogos y radiofísicos del Hospital Universitario Marqués de Valdecilla.
Pérez del Barrio explica que “cuando un paciente tiene una hemorragia intracraneal es difícil saber si va a evolucionar bien o mal”, apunta, “es complicado tomar decisiones en cuanto a darle un tratamiento más intervencionista o más agresivo”. “Hemos podido darnos cuenta de lo que puede ser útil en la práctica clínica gracias a tener un equipo de trabajo tan heterogéneo”, sostiene la radióloga.
Partiendo de esa premisa, “nos planteamos hacer un sistema de clasificación intracraneal en función de si el paciente tendría un buen o mal pronóstico, esa era un reto más ambicioso”, afirma Pérez del Barrio.
“Desde el IFCA, además de la experiencia trabajando con inteligencia artificial y aprendizaje profundo, también hemos aportado la infraestructura”, explica Lara Lloret, “no puedes hacer este trabajo de imagen médica, que son imágenes muy pesadas, con tu ordenador personal, hay que utilizar lo que se llaman las unidades gráficas de procesamiento, o CPUs, que las utilizamos para crear estas redes neuronales profundas”, añade.
Un modelo híbrido de predicción
Hasta ahora existían varios modelos de predicción para la detección de la hemorragia cerebral. Lo novedoso en este caso es que se presenta un modelo de aprendizaje profundo que predice el pronóstico de la enfermedad, es decir, si el paciente evolucionará favorablemente o no.
“Incluimos en el estudio a 262 pacientes de Cantabria que llegaban al servicio de urgencias de Valdecilla con sospechas de hemorragia intracraneal y con las imágenes de los distintos TAC cerebrales y sus datos clínicos, entrenamos un modelo personalizado para poder clasificar a los pacientes en mal pronóstico y buen pronóstico, utilizando un modelo híbrido”, explica la radióloga.
Este modelo se conoce como híbrido porque incluye dos grupos de datos: las imágenes del TAC y datos de cada paciente, y, por tanto, el rendimiento de la red mejora, “a más datos, mejores predicciones”, afirma Pérez. Esos datos se obtienen de información personal como, por ejemplo, la edad, sexo, si el paciente es fumador o consumidor de alcohol habitual, antecedentes médicos, hipertensión, diabetes, colesterol, y parámetros de la analítica de sangre realizada.
Para la médicoradióloga esta herramienta “podría tener un gran impacto en la toma de decisiones clínicas y ser muy útil para aplicar el aprendizaje profundo a otras imágenes médicas, como rayos X o ecografías”.
Medicina cada vez más personalizada
Para Lloret, este tipo de proyectos están englobados en lo que ahora se conoce como medicina personalizada, “en lugar de seguir trabajando con campanas de Gauss, basadas en promedios muy generales, debemos intentar que todo sea más personalizado, estudiar que una persona con un gen concreto que no le viene bien una medicación, debería tomar otra, y otra persona que aparentemente es igual, sin embargo tiene una variante genética distinta, a lo mejor la recomendación sería diferente”, afirma.
Este tipo de herramientas, sostiene Pérez, “son importantes para ayudar en la decisión sobre el tratamiento, que suele recaer en el cirujano o los intervencionistas”. Sin embargo, añade “estos sistemas vienen a ayudar, no buscan sustituir a nadie”.
Ahora el siguiente paso está en implementar estos sistemas de software en los hospitales, y “ver cuándo se debería dar esta información al paciente o su familia, o en qué momento se debe analizar la imagen”. “Ahora mismo no está implementado ni comercializado, pero es el futuro al que queremos llegar”, recalca . “Para eso se necesitan muchos más datos de pacientes, y entrenar sistemas de inteligencia artificial como éste e ir hacia un futuro, que yo creo es prometedor, de una medicina cada vez más personaliza”, finaliza Lloret.
Investigadores de la Universidad de Cantabria desarrollan una partícula que incrementa la formación contralada de hueso
Además, el Grupo de Ingeniería de Tejidos de la Universidad de Cantabria (UC), dirigido por elcatedrático de Bioquímica y Biología MolecularJosé Carlos Rodríguez Rey, ha desarrollado una partícula diseñada para incrementar la formación de hueso bloqueando una de las rutas de señalización que la inhiben. La partículaconsigue aumentaraproximadamente un 30% la masa ósea de ratones osteoporóticos.
De hecho, “estamos también desarrollando un tipo de partículas que, en lugar de ir dirigidas al hueso, van dirigidas a músculo”, por lo que se está intentando“hacer diferentes partículas para distintos tejidos que puedan servir para otras necesidades endiversos tratamientos”, ha señalado Rodríguez Rey.
Este hallazgo puede ser importante para la osteoporosis, caracterizada por una pérdida de masa ósea y densidad mineral, ya que el hueso está continuamente formándose y destruyéndose. “Si los procesos están en equilibrio, tenemos una masa ósea constante, pero si uno prevalece sobre el otro, yes más frecuente que la destrucción prevalezca sobre la formación, se dan procesos como la osteoporosis”, ha destacado el catedrático de la UC.
Además, según el investigador, “la ventaja que tiene esta partículaes que está diseñada para que vaya de forma específica a las células formadoras de hueso, al contrario que la mayoría de los medicamentos, que van indistintamente a todos los tejidos”. De esta forma, se ha modificado la partícula con un tipo de moléculas llamadasaptámeros, “que reconocen específicamente las células formadoras de hueso”.
Este descubrimiento, que ha dado lugar a la publicación del estudio en la revista ‘JournalofNanobiotechnology’, ha contado con la colaboración del Grupo de Tecnología Farmacéutica de la Universidad de La Laguna, que ha desarrollado una partícula hecha con un polímero en el cual se ha introducido una molécula capaz de inhibir la expresión de determinados genes. “Y el gen que hemos inhibido es uno de los que bloquea la formación de hueso, por lo que, al inhibir este gen hemos multiplicado su formación”.
Según Rodríguez Rey, una vez desarrollada la partícula diseñada para incrementar la formación controlada de hueso, su equipo está centrado en tres cuestiones básicas. “Primero, la composición de la partícula propiamente dicha. Segundo, podemos modificar el aptámero, es decir, la molécula que dirige a las partículas a las células determinadas, y conseguir una mayor especificidad. Y, por último, el propio contenido de la partícula. Ahí podemos poner un inhibidor de cualquier gen, lo que nos da muchas, muchas opciones”, ha avanzado el catedrático.



